
一种新型微流控系统,用于收集患者特异性NK细胞并在芯片内分离NK细胞分泌的外泌体,同时研究了NK细胞和外泌体与患者CTCs含量的相关性以及对CTCs的细胞毒性。
Introduction
癌症免疫治疗已成为一种很有前途的癌症治疗策略,最显著的是通过参与适应性免疫系统(如免疫检查点抑制剂)或通过涉及先天免疫系统的基于细胞的方法(如过继T细胞疗法,NK细胞疗法)。
- FDA在过去的十年中证实了其中的几种治疗方法,如免疫检查点抑制剂派姆单抗和伊匹单抗用于实体器官和血液系统恶性肿瘤,彻底改变了许多过去被认为无法治愈的癌症的治疗。
- 嵌合抗原受体(CAR)T细胞治疗,使用基因工程的T细胞在其表面显示嵌合抗原受体,被FDA批准用于治疗特定的难治白血病。然而基于T细胞的治疗存在:昂贵、工程化和扩增T细胞耗时、肿瘤细胞低主要组织相容性复合体(major histocompatibility complex, MHC)表达效果受限。
NK细胞是一种淋巴细胞,可以对多种细胞产生细胞毒性,在没有抗原呈递的情况下,能够破坏感染性细胞和转化细胞。NK细胞对被认为是转移种子的循环肿瘤细胞(CTC)的高细胞毒性先前已被报道。由于其广泛的细胞毒性和快速的反应,以增加NK细胞数量为目的的过继NK细胞治疗可能是一种很有前途的免疫治疗方法。与基于T细胞的治疗相比,NK细胞治疗是独立于抗原呈递的,可以更好地控制以减少细胞因子风暴的风险。
基于NK细胞的治疗仍然在努力克服基于细胞的治疗中的一些固有的限制,如以其靶向能力的限制缺乏递送适当数量的NK细胞进入肿瘤。例如,考虑到穿过血脑屏障(BBB)和血肿瘤屏障(BTB)的难度,用于脑癌的NK细胞治疗仍具有挑战性。为了克服这些限制,同时利用NK细胞的好处,一些研究小组最近研究了一些新的方法,如利用NK细胞来源的外泌体或小泡来改善基于NK细胞的免疫治疗方法。
NK细胞来源的外泌体为某些癌症的治疗提供了一种有效的选择。他们自然地表达IFN‐γ、FasL和多个细胞毒性蛋白,可以通过多种杀伤机制诱导细胞凋亡。外泌体固有的细胞-细胞转移能力可以进一步刺激肿瘤微环境活性或与周围细胞通讯,激活其细胞毒性作用。
因此,选择性地分离NK细胞并随后获得外泌体是一种很有前途的NK治疗方法。然而,由于分离高纯度、活的NK细胞群和随后收集这些细胞的外泌体的技术挑战,这种方法尚未成功实施。到目前为止,还没有一种简化的平台来分离特定亚型的细胞,并从异种样本中获取特定的外泌体。近年来,微流体和微设备已被用于从复杂标本中分离细胞和囊泡,其效率和灵敏度高于传统的基于大型设备的分离。
Figure 1. Schematic diagram of the microfluidic technology approach
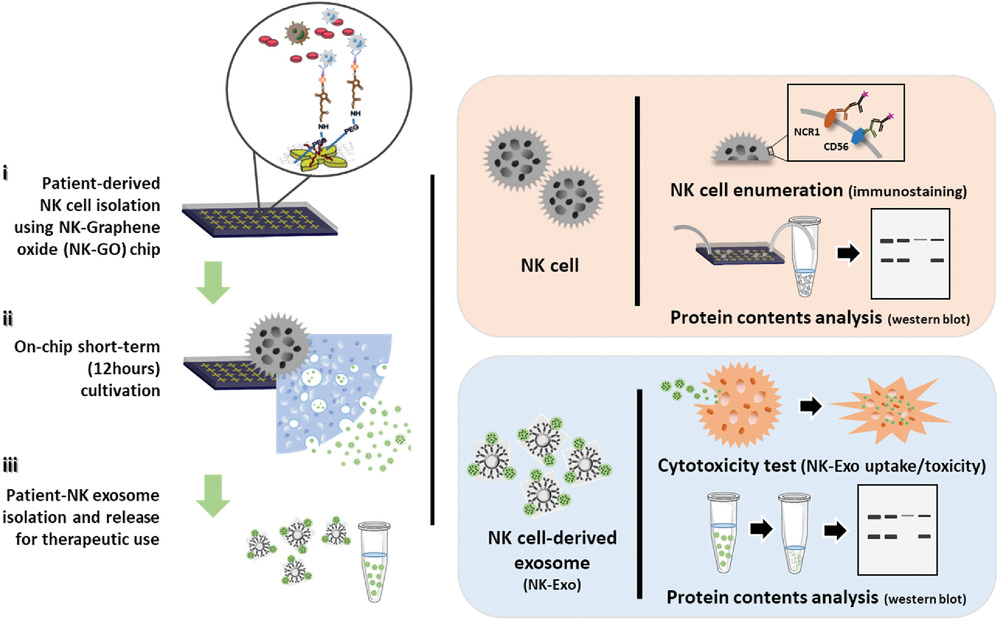
微流控技术方法用于NK细胞分离示意图,原位NK来源外泌体生物发生以及回收用于NK细胞外泌体潜在治疗使用。通过使用具有抗NK细胞抗体功能的氧化石墨烯微流控芯片(NK-GO芯片),能够在芯片上分离出高纯度和高活性的NK细胞,与没有氧化石墨烯沉积的相同尺寸的设备相比,二维氧化石墨烯沉积板具有更大的表面积,并提供了更多的结合位点来分离目标。由于氧化石墨烯的生物相容性,捕获的活NK细胞经过短期培养以分泌NK-Exo,并且可以使用抗CD63共轭磁珠(ExoBeads)实现NK-Exos的回收。这种温和且生物相容的释放过程使NK-Exos能够进行进一步的功能研究。
Figure 2. On-chip NK cell isolation and in situ exosome biogenesis and harvesting from the isolated NK cells

- (a)NK-GO芯片上原位的来自分离NK细胞外泌体生物发生。
- (b)NK-GO芯片与没有抗体偶联的对照装置相比较的NK细胞捕获表现.
- (c)不同细胞浓度和缓冲液的捕获效率如图所示,结果表明血液中NK细胞的捕获效率明显低于buffer中。
- (d)捕获的NK细胞取决于散落在buffer溶液中的NK细胞数。红色虚线是对数据的线性拟合。
- (e)不同时间点和条件下分离的NK细胞的活性以及NK细胞在芯片内孵化12 h后的活/死染色。发现在短期培养后,分离出的NK细胞的存活率超过70%。
- (f)NK细胞分泌的外泌体处决于孵化时间。
Figure 3. ExoBead-based NK exosome isolation and release for therapeutic use

- (a)用NK-GO芯片上清液孵育12 h后的ExoBeads上分离的外泌体小泡扫描电镜图像。清楚地显示,ExoBeads分离出了Exos,大小为80-130 nm。
- (b)三种不同的条件下,使用ExoBeads(ExoB)和与抗体不结合的对照Beads(ConB)从NK-92MI培养上清中回收外泌体囊泡的浓度和纯度。实验结果表明只有芯片上培养了NK细胞的上清液中能够检测到Exos,其纯度超过83%。
- (c)ExoBeads的捕获和释放性能取决于相同体积的NK-GO芯片上清液中Beads的数量。200 µg和400 µg的ExoBeads的捕获效率有显著差异,当ExoBeads数量加倍时,捕获效率提高30%,但两者的释放效率仅相差3.91%,最小释放效率为81.24%。
- (d)ExoBeads的捕获和回收性能取决于抗体偶联过程中D-生物素化的抗CD63的数量。对于所有浓度的D-生物素,捕获效率均>70%。1:20的D-生物素稀释比样品回收率显著降低,可能是由于链霉亲和素在D-生物素浓度为1:10和1:5时的发生结合位点饱和。
- (e)2种不同生物素溶液孵化时间下,体外外泌体释放的释放和纯度性能比较。
Figure 4. Cytotoxicity of NK cell-derived exosomes
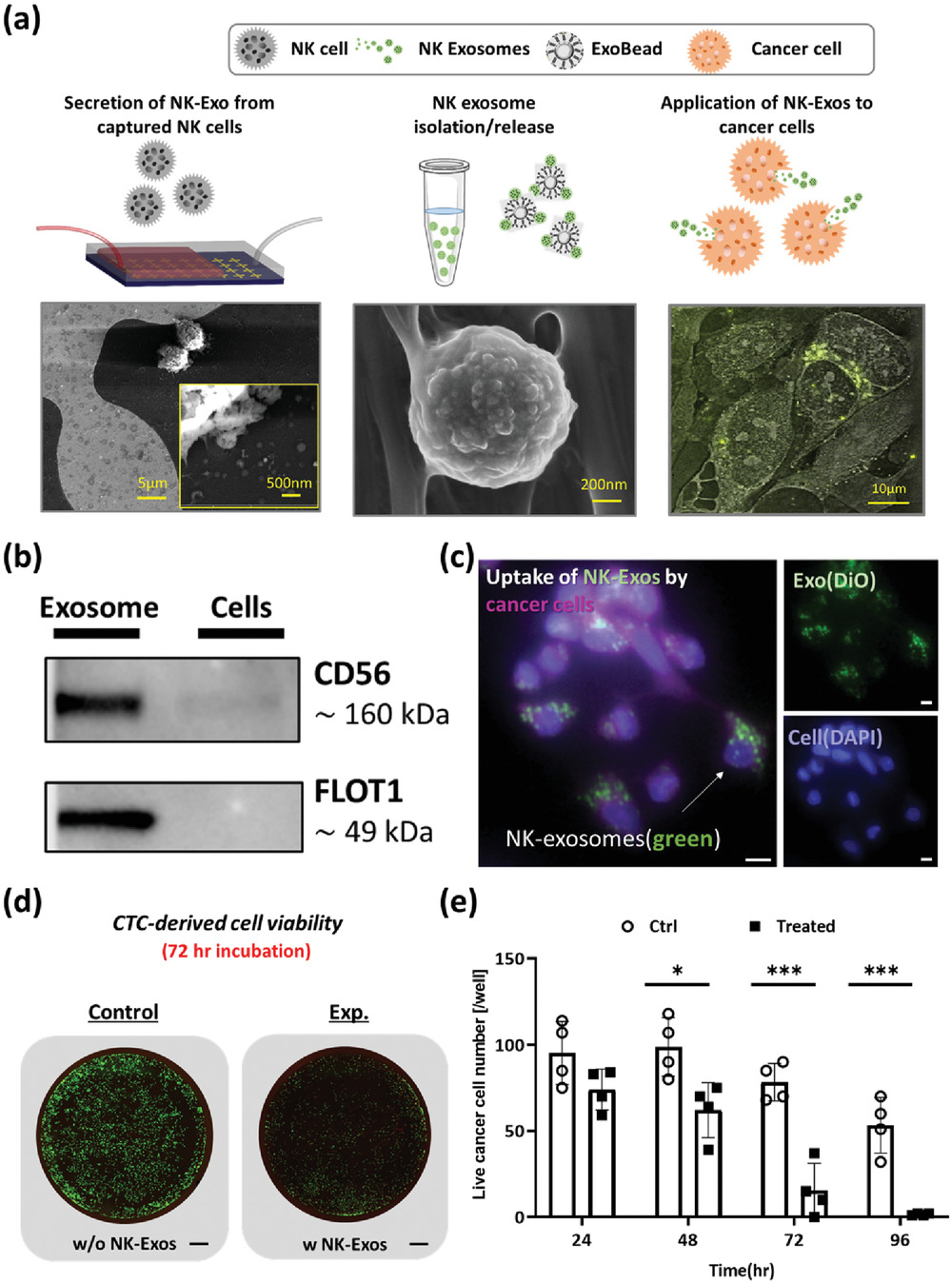
- (a)为了证明能够使用芯片从临床样本中收集NK-Exos,作者使用掺入血液的NK细胞模型样品来优化平台。从当前平台恢复的NK细胞(左)和NK外泌体(中),以及NK外泌体与癌细胞的治疗应用(右)。
- (b)散落在缓冲液的NK-92MI的蛋白质印迹分析评估捕获的细胞裂解液和胞外磁珠裂解液之间CD56和FLOT1表达情况,CD56在细胞裂解物和ExoBeads裂解物中都有表达,在ExoBeads裂解物中的表达量更高。此外,胞外体标记物FLOT1在分离的Exobeads裂解液中表达,但在细胞裂解液中不表达。
- (c)为了进一步评估癌细胞对NK-Exos的吸收,作者对NK-Exos与癌细胞共定位,结果显示NK-Exos位于癌细胞膜内,说明NK-Exos被癌细胞吸收。其中外泌体荧光标记为绿色通道(FITC),细胞膜荧光标记为紫色(Cy5)。
- (d)72小时对照孔和NK-Exos处理孔的细胞毒性比较。作者评估了NK-92MI来源的外泌体的潜在细胞毒性,使用免疫荧光扫描整孔,对比对照孔与NK-Exos处理孔,绿色荧光表示活细胞。
- (e)利用NK-92MI来源的外泌体进行体外细胞毒性实验。在使用NK外泌体或不使用NK外泌体处理癌细胞后24、48和72小时,通过活/死试验对活细胞进行定量。在所有情况下,由于细胞增殖,控制孔中的细胞数量增加,而在NK外泌体处理孔中,癌细胞在48小时出现峰值,但在72小时后下降并开始死亡。
Figure 5. Analysis of clinical samples from NSCLC patients using NK-GO microfluidic platform
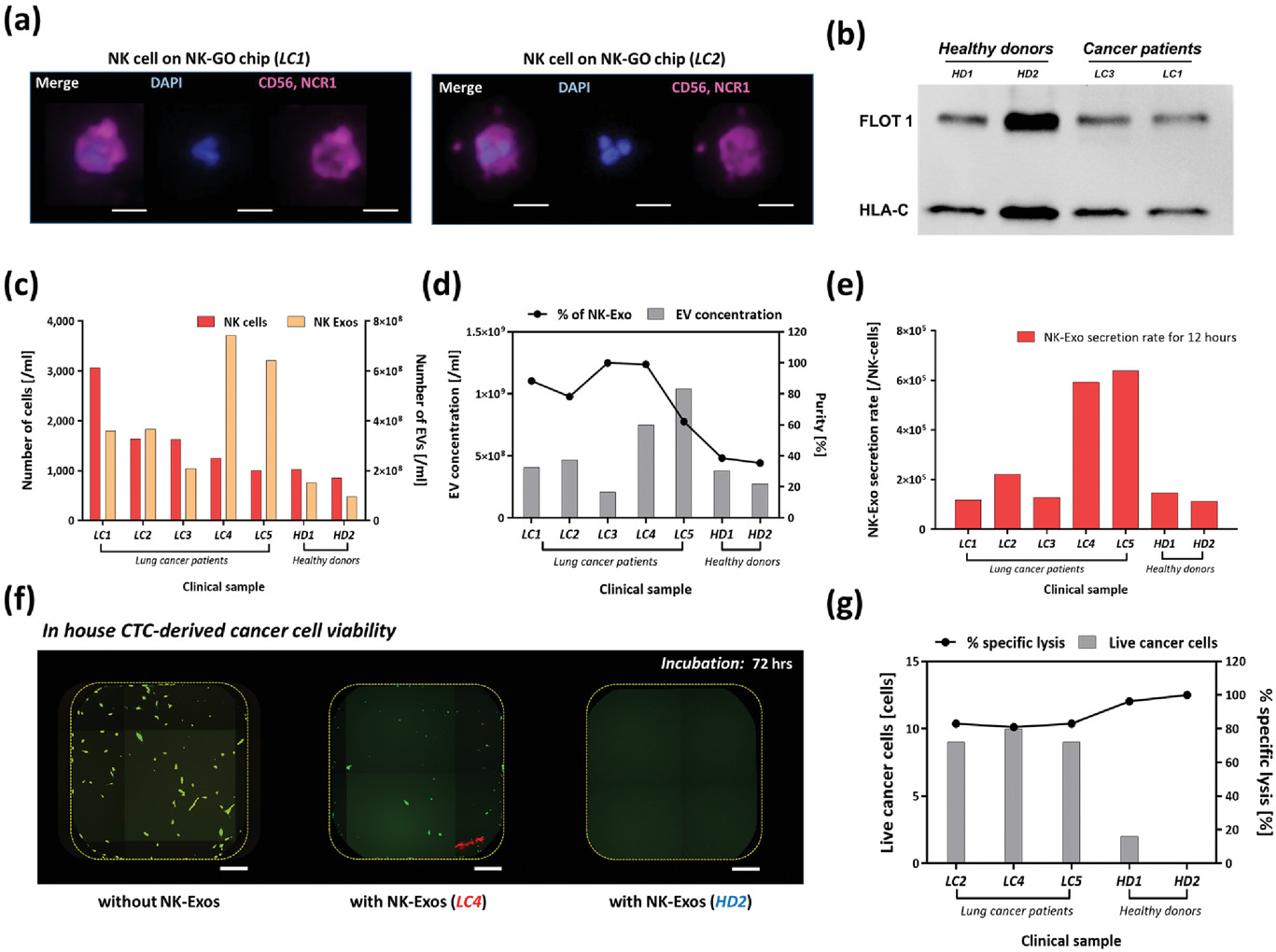
- (a)在NK‐GO芯片上捕获的CD56/NCR1+ NK细胞的免疫荧光图像实例。
- (b)蛋白质印迹分析以显示FLOT1和HLA-C在临床样品的外泌体中的阳性表达。
- (c)在芯片上孵育12小时后观察到的不同患者和健康个体中NK细胞和NK细胞衍生的外泌体的数量概况。
- (d)患者样品和健康对照样品之间的总细胞外囊泡浓度和外泌体百分比。
- (e)外泌体的生物发生,定量为每个捕获的NK细胞12小时的外泌体分泌速率。
- (f)孵育72小时后,来自癌症患者和健康供体的样品之间的活癌细胞数和特异性裂解的百分比。
- (g)孵育72小时后,临床样品驱动的NK-Exos对CTC衍生细胞的细胞毒性。
Figure 6. Profiling of circulating tumor cell (CTC) populations in non-small cell lung cancer (NSCLC) patients and correlation with NK cells and NK cell-derived exosomes
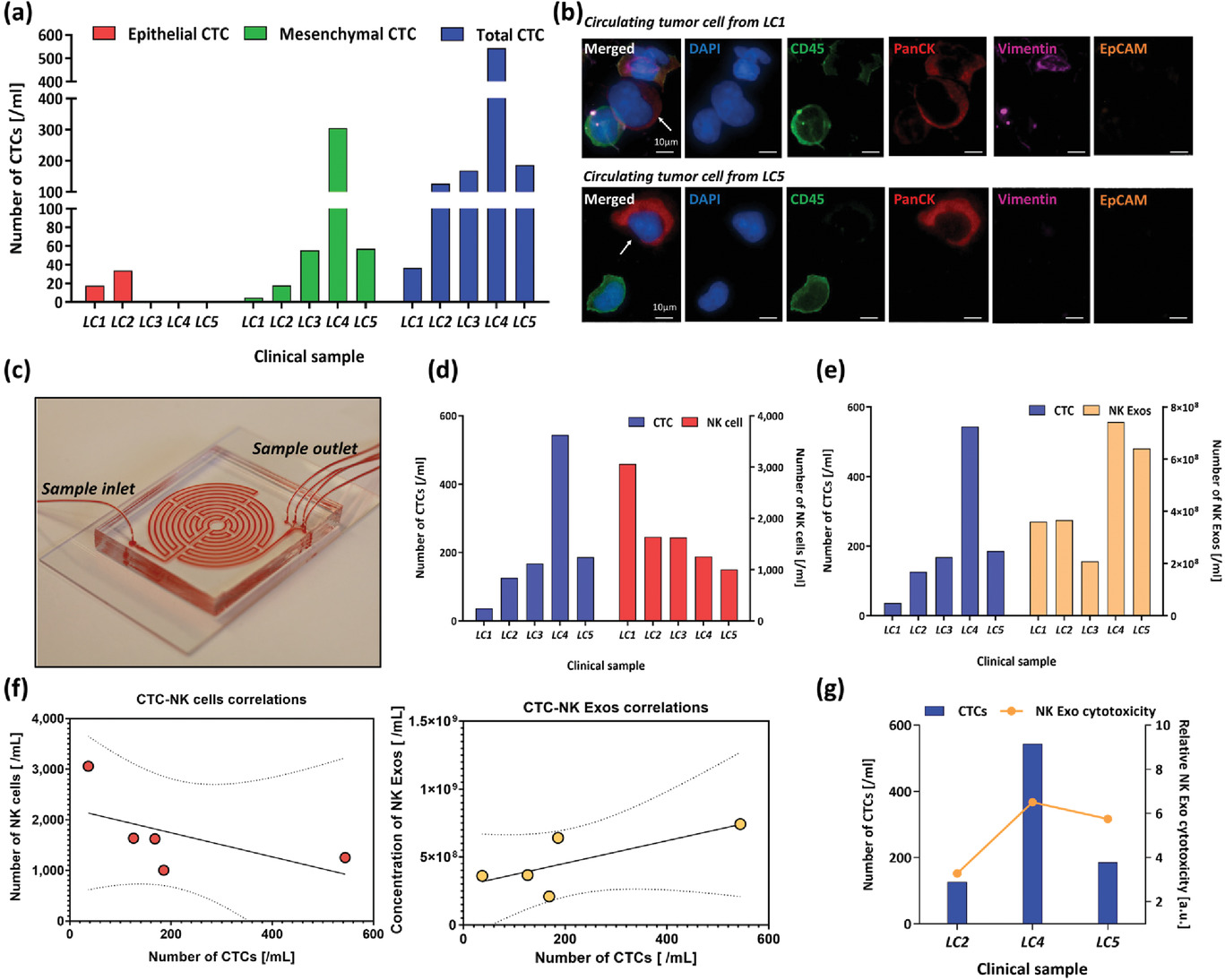
- (a)作者使用无标记循环肿瘤细胞分离平台对5例转移性IV期非小细胞肺癌患者的外周血液样本进行处理,以评估CTCs与NK细胞/NK-Exos之间的相关性。本图描述了5名患者的上皮/间质/总CTCs数。
- (b)显示了一些分离的单个/簇状CTCs通过染色为Panck(红色)、EpCAM(橙色)、Vimentin(粉红色)-阳性和CD45(绿色)-阴性,以区分CTC和白细胞(WBC)。
- (c)无标签CTC分离平台图片。
- (d)比较CTCs与NK细胞数量。
- (e)比较CTCs与NK-Exo浓度。
- (f)经过相关性研究,发现NK细胞数与CTCs数呈负相关(r=−0.580,P值=0.305),NK-Exos浓度与CTCs数呈正相关(r = 0.732, P值 = 0.159)。
- (g)为了评估单个样本的NK-Exos细胞毒性,同时考虑NK-Exos浓度和每个NK-Exos的癌细胞裂解性能,作者研究了NK-Exos相对细胞毒性。该相对细胞毒性值与血液中的CTCs数量密切相关。这一结果表明,虽然血液中的NK细胞数量本身可能并不影响总的细胞毒性,但由于NK细胞被大量的CTC活化使得血液中的NK-Exos浓度增加,从而大大提高了其抗肿瘤能力。
Conclusion
作者提出了NK-GO芯片,并且使用该芯片高效分离了NK细胞产生的NK-Exos,与健康人相比,非小细胞肺癌患者样本中含有大量的NK细胞和NK-Exos,并且与样本中CTCs数量呈现相关性。作者证明了NK-Exos的功能相关性,对内部患者来源的扩展CTC系具有细胞毒作用。考虑到CTCs在癌症治疗中具有重要诊断价值,免疫表型相关的免疫细胞如NK细胞能够补充并增强患者的预后监测。此外,这种精确的细胞分离也有助于研究CTCs与免疫细胞之间的相互作用,从而了解潜在的转移特异性免疫监视机制。
Reference
Kang Y-T, Niu Z, Hadlock T, et al. On-Chip Biogenesis of Circulating NK Cell-Derived Exosomes in Non-Small Cell Lung Cancer Exhibits Antitumoral Activity[J]. Advanced Science, 2021, 8(6): 2003747.



